Врски, врски, врски?
содржина
Средби со електрохемија Дел 5
За време на претходните состаноци бевме запознаени со многу примери на напонски ќелии - некои од историско значење, а други кои се користат денес. Светот на ќелиите е многу богат, па затоа е време да се воведат системи кои не се прикажани досега.
Неметалите можат да бидат и полу-клетки
Прво, експеримент кој бара две графитни електроди од потрошените елементи Лекланш, цинк бромид ZnBr2, извор на енергија (како батерија од 4,5 V) и незаменлив мерач на напон. Во домашна лабораторија, се разбира, нема да ја најдеме препорачаната цинкова сол, но во нашиот случај таа може успешно да се замени со мешавина од калиум бромид KBr и цинк (VI) сулфат ZnSO.4. Составуваме комплет кој се состои од две графитни стапчиња и ги прицврстуваме на таблата така што електродите делумно се потопуваат во стаклото.
Ние прицврстуваме парчиња жици на електродите, по можност со помош на рачка за лемење (затоа, кога ги отстранувате од старата батерија, оставете ги месинганите „капачиња“ на графитните шипки). Ќе направиме и дијафрагма од парче картон со димензии прилагодени на чаша со капацитет од 50-100 см.3 (картонот може дополнително да се пробие со игла).
Сега во вода растворуваме дел од споменатите соли, а потоа ја полниме чашата со подготвениот раствор (концентрација 5-10%). Ставете го држачот со електроди на работ на садот и закачете ги краевите на жиците на месинганите плочи на рамната батерија (поларитетот не е важен во овој момент) и набљудувајте го конструираниот систем.
Речиси веднаш, сребрено-сив сјаен слој се депонира на електродата поврзана со негативниот приклучок на батеријата. Направено од цинк метал. Жолтеникаво-кафеавата боја на растворот е видлива во близина на втората електрода поврзана со позитивниот приклучок на батеријата. Слободниот бром е обоен во близина на графитната прачка. По околу 5 минути, исклучете ги жиците од приклучоците на батеријата. Со помош на волтметар, измерете го напонот (негативот на мерачот е поврзан со електродата покриена со слој од метал).
Без да навлегуваме во процесите што се случуваат за време на електролизата (за нив ќе разговараме на еден од следните состаноци), можеме да заклучиме дека создадената ќелија се состои од две електроди: цинк (цинк метал депониран на графит во раствор на Zn2+) и бром (раствор на слободен бром и бромидни јони Br?). Јаглеродот е само спроводник на електрицитетот (во пракса, супстанциите кои се нереактивни под одредени услови, како што се графитот и платината, често се користат како материјали за електроди).
Дали ќе го поврземе тековниот приемник со електродите? сијалица со работен напон од 1,5 V (поларитетот на приклучоците исто така не е важен). Како што се извлекува енергија од системот, забележуваме постепено исчезнување на металниот талог на едната електрода и жолтеникава боја на другата. Претходно ослободените супстанции реагираат, враќајќи ја нивната првобитна состојба. Реакцијата е индиректна со пренос на електрони низ поврзувачката жица. Ова е суштината на галванските ќелии.
Какви реакции се случија во нашиот систем? За цинкова електрода секако можеме да ја дадеме равенката на процесот:
(-) Zn0 ? цинк2+ + 2e-
На втората електрода, слободниот бром се сведува на анјони на бром:
(+) Бр.2 + 2e- , 2 Бр-
Така, клеточниот дијаграм е како што следува (изоставуваме калиум и сулфат (VI) јони, кои не учествуваат во реакциите):
(-)C, Zn | ZnBr2aq? ZnBr2aq | C(+)
Не треба да користиме дијафрагма во ќелијата. Сепак, неговата употреба ќе спречи миграција на бром во близина на електродата обложена со цинк и директна реакција помеѓу елементите.
Неметалите формираат полу-клетки како метални елементи. Потребно е само да користите проводник потопен во соодветно решение што ќе учествува во преносот на електроните. За халогените, стандардните потенцијали се како што следува (реакцијата на електродата е слична на онаа дадена за бром):
| Polycell | F2/F? | Cl2/ Кл? | Br2/ Бр? | I2/I? |
| E0 [ВО] | + 2,87 | + 1,36 | + 1,07 | + 0,54 |
Во случај на флуор, потенцијалната вредност (највисока од сите утврдени за полу-клетки) беше пресметана наместо мерена. Причината, како и во случајот со алкалните и земноалкалните метали, е реакцијата на активниот елемент со вода.
редокс клетка
За следниот експеримент ќе ги подготвиме следните раствори: железо (III) хлорид, FeCl3 со концентрација од 5%, калиум јодид KI со концентрација од 10% и суспензија од вода-скроб. Измешајте неколку см во епрувета3 солени раствори и по некое време додадете неколку капки суспензија од скроб. Темно сината боја на содржината укажува на присуство на слободен јод. Реакцијата е напишана со равенката:
2 Fe3+ + 2i- ? 2 Fe2+ + Јас2
катјоните на железо (III) ги оксидираат јодидните анјони до слободниот елемент, намалувајќи ги до железни (II) јони.
Промената на бојата на индикаторот за скроб го потврди присуството на честички на јод, но дали се формираат и катјони Fe?2+? Ајде да ја тестираме оваа хипотеза. Карактеристичен тест за детекција на катјони на железо (II) е реакцијата со калиум хексацијаноферат (III) К3[Fe(CN)6], попознат како калиум ферицијанид. Соединението формира црвени кристали, за разлика од истоимениот калиум фероцианид (калиум (II) хексацијаноферат К4[Fe(CN)6]) со жолти кристали ? да не ги мешаме овие две врски. Да го повториме претходниот експеримент, но наместо суспензија од скроб ќе додадеме неколку капки 1% раствор на калиум ферицијанид. Повторно, содржината на садот за реакција станува темно сина поради сложената комбинација наречена сина Турнбул:
3 Fe2+ + 2[Fe(CN)6]3- ? Фе3[Fe(CN)6]2
За неверниците препорачувам тестирање со двовалентни и тривалентни соли на железо. Добиваме сина нијанса само во случајот на првата.
Сега истурете неколку раствори на железо (III) хлорид и калиум јодид во две мали чаши со капацитет од 50-100 cm.3. Во секој од садовите, потопете графитна електрода со закачена жица (поставена на соодветен држач за да не падне во стаклото). Исто така, додадете малку суспензија од скроб во садот со раствор од калиум јодид. За да креирате ќелија, ќе ви треба и електролитски клуч (направен за време на еден од претходните состаноци? Доволна е лента blotting хартија натопена во концентриран раствор KNO).3). Краевите на каблите од електродите се поврзани со терминалите на универзален метар инсталиран за мерење на напон.
Поларитетот на волтметарските врски го одредуваме сами врз основа на анализа на равенката за реакција на железните (III) катјони со јодни анјони, забележуваме од кои јони се откажуваат и кои прифаќаат електрони. Читањата на мерачот ја потврдуваат работата на галванската ќелија. Потоа го префрламе уредот на тековното мерење. Мал е (од редот на неколку десетици mA), така што не треба да користиме дополнителен приемник (како сијалица) за да го заштитиме уредот од оштетување. Појавата на реакција во системот е означена со формирање на темно сина боја околу електродата потопена во чаша со раствор од калиум јодид. Кога додаваме малку раствор на калиум ферицијанид во шејкерот за сол (III)? исто така во него. Да ги запишеме равенките на процесите што се случуваат во чашите:
(-) 2I- ? 2 + 2e-
(+) 2 Fe3+ + 2e- ? 2 Fe2+
и шемата на ќелиите:
(-) C | СЗОaq || FeCl3aq | C (+)
Во ќелијата се случуваат истите реакции како и по мешањето на подлогите во епрувета (доволно е да се додадат анодните и катодните процеси на страните), а просторното раздвојување на трансформациите овозможува енергијата на електроните пренесена помеѓу половините на клетката искористен.
Клетката што ја градиме се нарекува редокс клетка. Името е вообичаено, но погрешно. На крајот на краиштата, знаеме дека процесите на оксидација и редукција се случуваат во секоја врска. Како да се одреди насоката на редокс реакција (изведена и во ќелија и во епрувета)? Методот е едноставен:
1. Дали во физичко-хемиските табели ги наоѓаме стандардните потенцијали на соодветните полуклетки? за системот Fe3+/ Фе2+ ова е +0,77 V; за мене2/I?: +0,54 В.
2. Системот со поголем потенцијал е оксидирачкиот агенс во реакцијата (клетка-катода), а полуклетката има помал потенцијал? анодата на ќелијата, односно редукционото средство.
3. Сепак, треба да се запомни дека за системи со мала разлика во вредностите на стандардните потенцијали, во некои случаи улогите може да се променат (вистинските потенцијали зависат и од концентрацијата на реагенсите).
Горивна ќелија
Ајде да го составиме системот од првиот експеримент, заменувајќи го само растворот од калиум бромид и цинк (VI) сулфат со 10% раствор на сулфурна киселина (VI) H2SO4. По 1-2 минути електролиза (која се јавува со ослободување на гас на електродите), исклучете го изворот на енергија и внимателно за да не се отстранат гасните меури од површината на графитот, измерете го напонот со волтметар. Линкот е создаден! Откако ќе го префрлите уредот во режим на тековно мерење, можете да го набљудувате исчезнувањето на меурчиња со гас на површината на графитните електроди за време на процесот на реакција. Ако не навлеземе во деталите на процесот што предизвика таложење на слободен кислород и водород на електродите, тогаш реакциите во ќелијата изгледаат вака:
(-)2H2? 4 часа+ + 4e-
(+)2 + 4 ч+ + 4e- ? 2 часа2O
Севкупно, се јавува реакција на синтеза на вода од елементи.

Конструираниот систем е модел на горивни ќелии. Дали директното претворање на енергијата на реакцијата помеѓу горивото и оксидаторот во електрична енергија е исклучително корисна од гледна точка на економичноста на процесот? Нема потреба топлината од согорувањето да се претвора во енергија на пареа, која само ги придвижува турбините. Не е изненадувачки што таквите системи се дизајнирани да решаваат енергетски проблеми (а отпадот е чиста вода). Сепак, цената на градежните материјали и потребата за производство на водород се главни пречки.
Иако горивни ќелии се користат за производство на електрична енергија во технолошки најнапредните полиња како што се вселенските летови (во некои индустрии, трошоците играат второстепена улога), нивната историја е многу долга. Првиот работен прототип на водород-кислородна ќелија бил изграден од британскиот пронаоѓач Вилијам Роберт Гроув во 1839 година.
Во написот се претставени неколку видови врски кои се различни од оние што се дискутирани на претходните состаноци. Дали ви се допаѓаат останатите епизоди? Наведени се само проблемите на овие системи, кои се важни не само како извор на енергија. Сепак, потребата да се одржи разумна големина на текстот го оневозможува дискусијата за многу интересни теми поврзани со референци (ги охрабрувам заинтересираните читатели да направат сопствено истражување). Во следната епизода од серијата ќе ја анализираме табелата со потенцијали на половина ќелии. Ќе има и понуди за интересни искуства.
електронска апликација
редокс клетка
Секоја галванска ќелија се подложува на оксидација (на анодата) и редукција (на катодата). Меѓутоа, во хемискиот жаргон, редокс клетките се нарекуваат специфичен тип на систем.
За да го спроведете експериментот, ќе ви требаат раствори на калиум јодид KI и железо (III) хлорид FeCl.3 и водена суспензија на скроб (компир брашно). Ќе ви треба и електролитски клуч исполнет со концентриран раствор на калиум нитрат (V) KNO3. Доколку немаме клуч, доволно е неколку пати да свиткаме лента марамче или памучна нишка натопена во раствор од калиум нитрат.
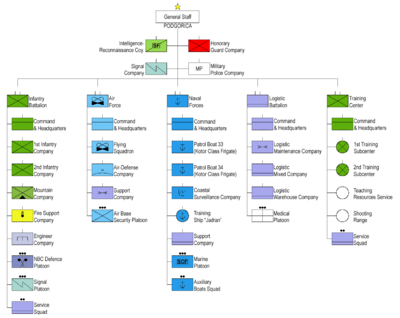
Како електроди ќе користиме графитни шипки од искористените Leclanche ќелии (слика 1). Краевите на електродите се краток спој со жица и се потопуваат во чаши со раствори од KI (со додавање на скробна суспензија) и FeCl.3. Дополнително, растворите во чаши ги комбинираме со електролитски клуч или некоја негова замена (слика 2). По некое време, виолетовите ленти почнуваат да се појавуваат во чаша со раствор од калиум јодид (слика 3), постепено претворајќи го садот во темна боја (фотографии 4 и 5). Ова е карактеристичен производ од комбинацијата на молекули на слободен јод со молекули на скроб. Јодот е формиран како резултат на оксидација на јодидни анјони на анодата на клетката:
(-) Анода: 2I- ? 2 + 2e-
На втората електрода (катода), се случи редукција на јоните на железо (III):
(+) Катода: 2Fe3+ + 2e- ? 2 Fe2+
Редокс клетката создадена во експериментот ја има следнава шема:
(-) C | СЗОaq || FeCl3aq | C (+)
каде јаглеродниот симбол C означува графитна електрода и || ? електролитски клуч. Целокупната реакција во системот е оксидација на анјоните I- со катјони на Fe3+:
2 Fe3+ + 2i- ? 2 Fe2+ + Јас2
редокс клетка
концентрациона клетка
За вториот експеримент ќе ви требаат: раствор од бакар сулфат (II) CuSO4, бакарни електроди, електролитски клуч исполнет со концентриран раствор на калиум нитрат (V) KNO3 и универзален бројач. Наполнете една од чашите со раствор CuSO.4а другиот со исто разредување 1:100 (на пример, 0,5 см3 Додадете го растворот земен од првата чаша со вода до волумен од 50 см3) (слика 6). Откако ќе ги потопите бакарните жици во чашите и ќе го затворите колото со електролитски клуч, измерете го напонот помеѓу електродите на ќелиите. Мало е? околу десетина или неколку десетици миливолти (слика 7).
Реакциите на растворање и таложење на бакар се случуваат на електродите:
(-) Анода: Cu0 ? Со2+ + 2e- (помалку концентриран раствор)
(+) катода: Cu2+ + 2e- ? Со0 (поконцентриран раствор)
По додавањето на равенките на двата процеса на електродата, излегува дека вкупно не се случува хемиска реакција! Движечката сила зад работата на ќелијата е само желбата на системот да ги изедначи концентрациите во двете чаши.